细胞组装作为构建细胞阵列、组织模型乃至类器官的关键环节,本质上是一种以细胞为基本单元的精密制造过程。当前,组织工程与药物筛选等领域对高效、高通量、高精度细胞组装技术需求迫切。行业内亟需一种能够平衡精度、效率与规模的全新方法。
针对上述需求,清华大学汪家道课题组提出了一种流体驱动的细胞组装方法(Flow-Driven Cell Assembly, FDCA),巧妙融合微模板定位与流场调控的双重优势。该方法利用光刻技术制备微孔膜作为细胞“座位”,通过近壁流场产生的曳力,引导细胞定向运动、快速落座,实现精准图案化组装。随后,细胞阵列可被整体转印至水凝胶基底,并通过逐层堆叠策略构建复杂的三维组织。
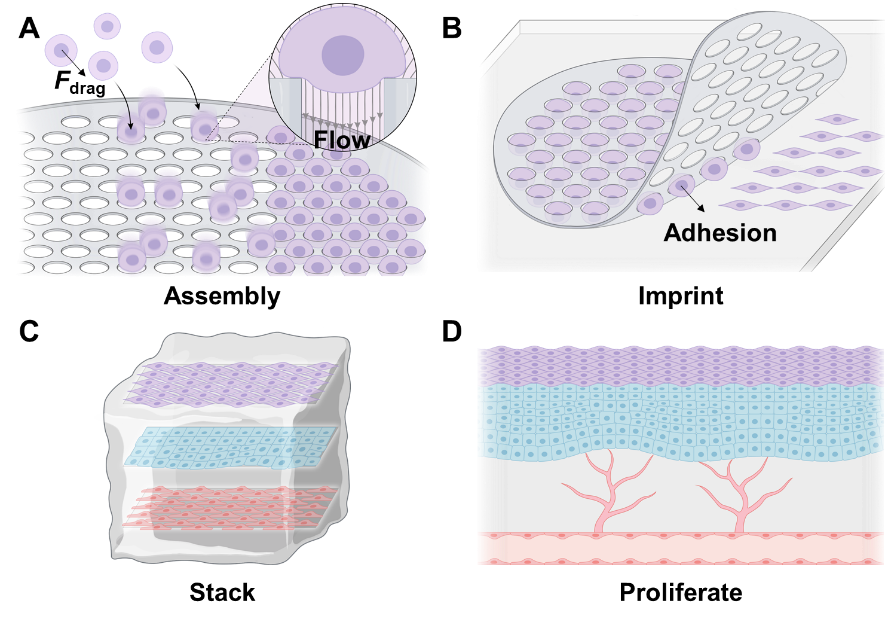
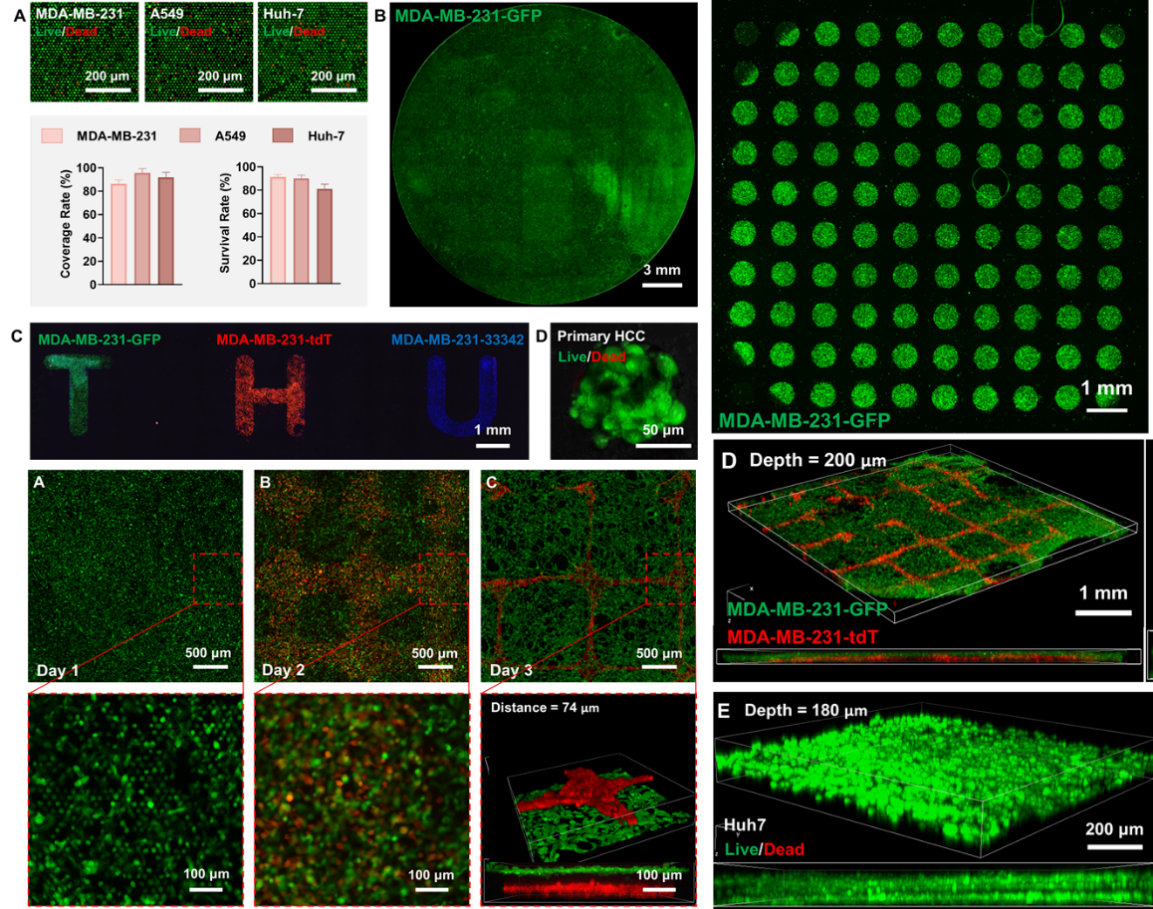
该方法展现出诸多优势:支持多种细胞系与原代细胞的高效组装,组装面积可达3 cm⟡,细胞密度高达10⁷ cells/cm³,并可借助定制化光刻掩模实现层内与层间的复杂图案化,为制备大面积类器官阵列奠定基础。这一技术路径,为高通量药物筛选和组织工程应用提供了前所未有的批量化细胞组织制造手段。
进一步研究发现,经FDCA技术组装并转印的细胞,在上皮-间充质转化过程中,展现出与传统二维培养及三维微球培养显著不同的生物学行为,包括细胞骨架重排和关键蛋白表达的差异。这表明FDCA不仅能维持高细胞活性,还为细胞提供了更接近体内真实组织的三维微环境,在模拟疾病机制和药物反应方面性能良好。
该研究成果以“Rapid, Large-scale and Precise Cell Assembly for Tumor Model Fabrication via Template-modulated Flow-driven Strategy”(流体驱动的细胞组装方法)为题,发表于《Advanced Materials Technologies》(《先进材料技术》)。清华大学机械工程系2021级博士生陈逸卿为第一作者,汪家道教授与马原助理研究员为共同通讯作者。博士后王玉娇、博士生张轩鹤、梁真为、余郭煦等亦对该工作做出贡献。该研究获得国家自然科学基金委项目支持。
原文链接:http://doi.org/10.1002/admt.202500295